Indice do post
ToggleTanto no Brasil quanto no resto do mundo, há uma visível dificuldade em reclassificar a cannabis para que ela possa ser prescrita por médicos e produzida para pacientes. Apesar das recentes legalizações, ainda há uma resistência generalizada em aceitar o valor medicinal da erva.
O Dr. Lester Grinspoon conta, em “History of Cannabis as Medicine”, como observou (nos Estados Unidos) os advogados da Winthrop Pharmaceuticals reclassificarem a droga Talwin — uma droga carregada de evidências de abuso e mortes por overdose, com efeitos colaterais perigosos — com certa facilidade, para uma categoria de drogas menos restritiva (schedule VI).
Enquanto isso, a cannabis, sem nenhuma evidência de morte e com efeitos colaterais leves, teve o pedido de reclassificação para uma categoria de drogas restritas, mas que podem ser prescritas por médicos (schedule II), negado.
A maconha continua fazendo parte da categoria de drogas mais restritiva nos Estados Unidos (schedule I). No Brasil, o CBD (um dos mais de 400 componentes da maconha) foi reclassificado e medicamentos que incluem THC e outros canabinoides podem ser autorizados caso a caso por determinação da justiça, mas a maconha em si ainda é ilegal para uso médico*. Por que isso acontece?
Como drogas são aprovadas
Primeiramente, é preciso compreender o processo de aprovação de uma droga para que ela seja usada como remédio. Aqui vai uma resumida – mas bem resumida, mesmo:
Fase pré-clínica: testes laboratoriais usando o medicamento e células (in vitro); testes em animais (in vivo) para determinar uma dosagem aproximada e a segurança do medicamento.
Fase I: teste em um ser humano saudável (e corajoso), para determinar a segurança da substância. O ideal é que esse estudo se inicie com uma pessoa só, mas essa fase inicial pode utilizar 20 a 100 pessoas, determinando também interação do medicamento com outras drogas.
Fase II: 100 a 300 indivíduos com a enfermidade a ser tratada fazem parte dessa fase de testes, que começa a determinar a segurança e a eficácia do medicamento.
Fase III: Milhares de pacientes são avaliados. Nessa fase, os pacientes são divididos em dois grupos: um dos grupos recebe o medicamento novo a ser testado e o outro recebe o placebo (pílula de açúcar). Se já houver tratamentos disponíveis, então o melhor tratamento no mercado será oferecido no lugar do placebo. Essa fase analisa com mais precisão a eficácia do medicamento e avalia a segurança através dos possíveis efeitos colaterais.
Fase IV: O medicamento já está disponível no mercado, mas ainda há um acompanhamento dos efeitos do medicamento.
Os pacientes devem ser selecionados de modo a representar da melhor forma possível a população que irá consumir a droga. Em cada etapa desse processo, os resultados devem ser publicados e são criticados por pesquisadores independentes, que verificam se há tendenciosismo, falhas de design na pesquisa ou algum erro, etc. Se as falhas se comprovarem, os estudos são refeitos ou reformados para atender as normas de pesquisa.
Toda pesquisa passa por um comitê de ética antes de ser feita, para que estudos perigosos não sejam realizados sem os cuidados necessários. Os resultados das pesquisas são enviados para órgãos reguladores (como a Anvisa), que os analisa e decide se o medicamento pode entrar no mercado.

No entanto, de acordo com Ben Goldacre, as coisas não costumam ocorrer assim:
“Drogas são testadas pelas pessoas que as fabricam, em estudos mal elaborados, em um número pequeno de pacientes estranhos, que não representam a maioria, e analisados utilizando técnicas que são propositalmente falhas de modo a exagerar os benefícios do tratamento. Não surpreende que esses estudos tendam a produzir resultados que favorecem o fabricante. Quando estudos regurgitam resultados que as empresas não gostam, elas podem muito bem escondê-lo de médicos e pacientes, para vermos apenas uma versão distorcida dos verdadeiros efeitos da droga. Órgãos reguladores observam a maior parte dos dados dos estudos, mas apenas dos primeiros estágios do ciclo de vida da droga, e mesmo assim eles não dividem esses dados com médicos e pacientes, ou mesmo com outros membros do governo. Essa evidência distorcida é então comunicada e aplicada de maneira distorcida. (…) Finalmente, artigos acadêmicos, que todos pensam ser objetivos, costumam ser devidamente planejados e escritos por pessoas que trabalham diretamente para essas empresas, em segredo. Às vezes, revistas acadêmicas inteiras são propriedade de uma empresa da indústria farmacêutica. Além disso tudo, para diversos dos mais importantes e duradouros problemas da medicina, nós não temos ideia de qual é o melhor tratamento, pois não é do interesse financeiro de ninguém conduzir pesquisas nesse sentido”. (Goldacre, 2012, p.xi)
Esse trecho foi extraído do livro “Bad Pharma”, onde o autor critica o comportamento da indústria farmacêutica. Parece muito a opinião pessoal do autor? Então vamos a alguns dados.
- Em 2003, Justin E. Bekelman e colegas demonstraram que um quarto de todos os pesquisadores realizando testes clínicos estavam diretamente afiliados a empresas da indústria farmacêutica; e que dois terços de instituições acadêmicas estavam financeiramente ligadas às empresas que financiam estudos nessas instituições. O mesmo estudo concluiu que pesquisas financiadas pela indústria têm 3,6 vezes mais chances de apresentarem resultados que favoreçam o produto.
- Em um estudo desenvolvido em 2007, foi verificado quantos dos pacientes usados em estudos para medicamentos contra asma realmente eram representativos. Os pesquisadores selecionaram 179 pacientes representativos e depois aplicaram os critérios utilizados pela indústria. Somente 6% dos pacientes foram selecionados. Isso indica que a indústria tende a selecionar pacientes “ideais”, como aqueles que têm mais chances de melhorar, com poucas complicações, que praticam mais exercícios, se alimentam melhor, não possuem outras enfermidades, etc. Na vida real, contudo, a maioria das pessoas a utilizar o medicamento não entra nesse perfil, conforme foi demonstrado na pesquisa.
- Outros estudos demonstram uma série de técnicas para manipular os resultados, fazendo com que pareçam mais positivos, como interromper o estudo mais cedo (quando, por coincidência, a maioria dos pacientes está se sentindo melhor ou apresentando menos efeitos colaterais); estender o estudo por um período de tempo maior, mas não observar efeitos colaterais nesse período; selecionar um grupo de pacientes que por acaso está reagindo melhor ao medicamento, dentro do grupo total (por exemplo: mulheres brancas entre 35 e 45 anos); etc.
- Muitas vezes, quando estudos apresentam resultados negativos, os resultados são escritos de forma a mascarar esse resultado e aparentar ser positivo. Em 2008, pesquisadores observaram que, de 74 estudos realizados com antidepressivos (representando 12500 pacientes), 38 apresentavam resultados positivos e 36 negativos, sobre 12 medicamentos diferentes. 37 dos 38 estudos com resultados positivos foram publicados integralmente; três dos 36 estudos com resultados negativos foram publicados, 22 deles nunca vieram a público, e onze foram reescritos para se transformarem em positivos. Então de 38 resultados positivos e 36 negativos, foram publicados 48 positivos e 3 negativos(!).
Essa é apenas uma fração do problema. Enquanto a indústria gasta milhões em pesquisas duvidosas e marketing, como um medicamento natural consegue competir com isso tudo?
A erva medicinal
Existem milhares de pesquisas sobre o uso da cannabis para o tratamento das enfermidades mais diversas. No entanto, apesar de a segurança da erva já estar demonstrada em diversas pesquisas de fase I e II, é muito difícil conseguir aprovação para um estudo clínico grande.
Também é complicado conseguir fundos para a realização dessas pesquisas, já que não é do interesse do governo (em países diversos) realizar pesquisas com uma droga ilegal, nem da indústria farmacêutica, que não tem como patentear medicamentos naturais; sendo assim, pesquisas devem ser realizadas de forma independente. E sem o lobby da indústria, fica mais difícil interagir com órgãos reguladores. O Dr. Donald Abrams, na Califórnia, esperou vinte anos para um de seus estudos sobre o uso da cannabis na manutenção da Aids ser aprovado.
De fato, há um ativo lobby contra a cannabis sendo realizado pela indústria. Nos Estados Unidos, cerca de metade das doações a movimentos antidrogas, como o “Famílias Contra a Maconha”, vêm de empresas da indústria farmacêutica. Lee Fang, da Vice News, descobriu em sua investigação, em 2014, que acadêmicos com grande presença na mídia que se posicionam contra a maconha, como o americano Herbert Kleber, estão sendo pagos por empresas da indústria farmacêutica; em especial, fabricantes de analgésicos opiáceos (há uma redução significante no consumo de opiáceos em estados onde a maconha foi legalizada para uso medicinal).
No Brasil, uma série de acadêmicos com interesses na indústria são comumente ouvidos pela mídia. Um exemplo é o Dr. Alexandre Crippa, que realiza pesquisas com o CBD isolado e está sempre aparecendo no Fantástico com uma visão negativa do THC e da cannabis in natura.
A indústria da maconha medicinal
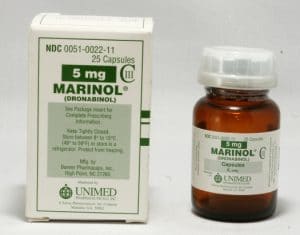 Apesar da dificuldade em aprovar a cannabis em sua forma natural, não foi tão difícil, nos anos 1970, aprovar o equivalente sintético do THC, mais conhecido comercialmente como Marinol. Conforme aponta Denis Russo Burgierman, o Marinol foi um fracasso. O THC isolado, em forma de cápsula, causa efeitos colaterais mais incômodos do que a planta natural, deixando o paciente dopado. De fato, em todos os estudos comparando a maconha com o Marinol, os pacientes preferiram a maconha – exceto por um estudo, financiado pela empresa que produz o Marinol.
Apesar da dificuldade em aprovar a cannabis em sua forma natural, não foi tão difícil, nos anos 1970, aprovar o equivalente sintético do THC, mais conhecido comercialmente como Marinol. Conforme aponta Denis Russo Burgierman, o Marinol foi um fracasso. O THC isolado, em forma de cápsula, causa efeitos colaterais mais incômodos do que a planta natural, deixando o paciente dopado. De fato, em todos os estudos comparando a maconha com o Marinol, os pacientes preferiram a maconha – exceto por um estudo, financiado pela empresa que produz o Marinol.
Similarmente, um estudo comparando o CBD isolado e uma cepa de cannabis rica em CBD, determinou que a forma natural da cannabis é mais eficaz que o CBD em seu efeito anti-inflamatório.
Por ser um produto natural, a maconha não pode ser patenteada; isso significa que a indústria não pode manipular sua venda. Qualquer pessoa pode plantar seu medicamento e ele será tão eficaz quanto o produzido pela indústria. Não há interesses financeiros na liberação da cannabis para uso medicinal (ou qualquer outro uso). Pelo menos não para gigantes corporativos. A liberação do uso medicinal da cannabis só ocorrerá, portanto, quando a pressão popular for mais forte do que a corporativa.
Apesar de ser possível importar medicamentos à base de cannabis conforme aprovação caso a caso por parte da Anvisa, perante apresentação de prescrição médica e uma série de documentos, a erva ainda é proibida em território nacional, tornando difícil a aprovação de sua produção para uso médico pessoal, pesquisa ou para comercialização.
Como é prevista por lei essa possibilidade de autorização, contudo, há processos na justiça desses pedidos, mas trata-se de processos lentos e onerosos. Caso a planta em si fosse aprovada para uso medicinal, acredita-se que esses processos seriam simplificados, facilitando o acesso a pacientes, médicos e pesquisadores.